von Yeliz Akkul und Robin Schmies
Treffpunkt 1: Der Aussichtspunkt Cabo Girão
Den ersten Halt am letzten Tag unserer Madeira-Exkursion machten wir am 20.02.2019 am Aussichtspunkt Cabo Girão (32°65‘70“N, 17°0‘51“W). Das Cabo Girão (von port.= Kap der Umkehr) ist eine 580 Meter über dem Meeresspiegel hohe Steilklippe, bestehend aus Basalt und Pyroklastika, im Süden Madeiras in der Nähe der Ortschaft Câmara de Lobos. Mit seinen 580 Metern Höhe ist Cabo Girão das höchste Kap Europas und die zweithöchste Steilklippe der Welt und deshalb eine von Madeiras berühmtesten Touristenattraktionen. Die auch schon am frühen Morgen gut besuchte Aussichtsplattform verfügt über einen im Jahr 2012 errichteten, halbkreisförmigen, transparenten Glasboden, der auch als „Skywalk“ bekannt ist und auf dem jeder seine ersten Schritte „wie auf Eiern“ geht 😉. Von dort aus gab es eine spektakuläre Aussicht auf die Südküste Madeiras und einen beeindruckenden Weitblick auf den tiefblauen Atlantischen Ozean bei tollem Wetter. Der Aussichtspunkt bietet außerdem eine wunderschöne Aussicht auf den Fischerort Câmara de Lobos und die Inselhauptstadt Funchal.


Am Fuße der Klippe existieren ein wunderschöner Strand und bepflanzte Terrassenfelder, bekannt als „Fajãs do Cabo Girão“. Die Felder waren früher nur mit einem Boot zu erreichen, seit 2003 gibt es am Hang eine Seilbahn, die ursprünglich als Transportmittel angelegt wurde, um den Bauern die Feldarbeit zu erleichtern.
Treffpunkt 2: Geochemie in Madalena do Mar
Einleitung
Nach der spektakulären Aussicht in Cabo Girão fuhren wir weiter nach Westen zum Küstenort Madalena do Mar, wo wir um 10:50 Uhr eintrafen. Es war sonnig, nahezu windstill und laut Thermometer war es 19 °C warm. Der Parpklatz (N 32.70143° W 017.13559 °, 30 m ü. NN) befindet sich an der Mündung eines Baches, dessen Wasser als auch des Atlantiks, wie später beschrieben, für geochemische Analysen genutzt wurde.
Da die Dozenten aufgrund einer Probennahme am Ribeiro Brava (MAD 10) verspätet eintrafen, blieb uns Zeit in der Sonne zu entspannen und die Dikes auf der nahe gelegenen Felswand zu fotographieren.

Crashkurs Geochemie
Mit dem Wissen, dass wir an dem Tag titrieren werden, um sich eine Vorstellung von der Verwitterungsrate der Gesteine auf Madeira machen zu können, gaben uns die Dozenten zuvor eine Wiederholung zur Alkalinität aus der Vorlesung “Anorganische Geochemie” :

Somit ist die Alkalinität ein Maß für das Säurebindungsvermögen (in unserem Fall von natürlichen Wässern), dessen Stärke wiederum abhängig ist von der Menge der enthaltenden Ionen , z.B. die des Carbonat-Ions. Die für die Titration nicht erfassbaren bzw. zu schwachen Ionen wurden durchgestrichen, sodass die Ionen übrig geblieben sind, die mit einer starken Säure reagieren (hier: Schwefelsäure) und bei einem pH-Wert von 4,3 zum größten Teil neutralisiert sind. Diese Methode ist eine kostengünstige Methode für die Quantifizierung des gebundenen bzw. verwitterten Kohlenstoffs.
Der Digital Titrator

Der Digital Titrator besteht aus einem Rädchen mit einer Anzeige der Schritte (Digits), die man gedreht hat, sowie einem Zapfen, an dem die Säurepatrone befestigt ist, und dem Ablassschlauch unter dieser. Dreht man ein Digit weit, werden exakt 1,25 Mikroliter der angeschlossenen Säure in den Behälter unterhalb getropft (siehe Bild). Dies lässt sich aus der Angabe berechnen, dass 800 Digits 1 ml entsprechen. Dabei muss man auf mögliche Luftblasen im Ablassschlauch achten. Zusätzlich musste man die Etiketten der Säurepatronen erst verstehen lernen, da hier 1,6 N bzw. 0,16 N H2SO4 drauf stand. Das N bezieht sich nämlich hier auf die Normale der Schwefelsäure und da es sich um eine zweiprotonige Säure handelt, ist der Wert für eine Umrechnung in die bekannte molare Schreibweise lediglich durch zwei zu teilen. Für die anschließende Berechnung der totalen Alkalinität der Proben ist dies jedoch nicht erforderlich, da die folgende Formel mit der Schreibweise der Säurepatrone funktioniert:
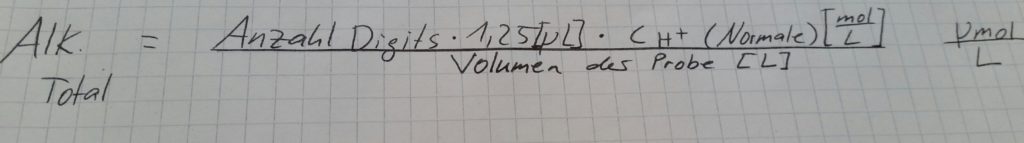
Titrieren im Feld
Nach dieser Einführung haben wir uns jeweils in Zweier-Teams mit dem Digital Titrator vertraut gemacht, indem normales, im Supermarkt erhältliches Mineralwasser titriert wurde, bis der hinzu gegebene Indikator (Brommethylgrün) auf Lila umschwank. Nachdem die Augen für das Finden dieses Punktes geschärft wurden, konnte mit den 10 bisher gesammelten und den zwei vor Ort genommenen (aus dem Bach und aus dem Meer) Wasserproben “scharf geschossen” werden.
Auch hier titrierte jeweils eine Person des Teams und die andere hielt das Probengefäß in einer gekippten Stellung für die optimale Erkennung des Umschlagpunktes. Danach wurde mit derselben Probe getauscht, sodass zwei verschiedene Werte für die Volumina der Proben und Anzahl der benötigten Digits notiert wurden und dementsprechend nach Einsetzung in der oben gezeigten Formel pro Probe zwei Ergebnisse für die totale Alkalinität errechnet wurden. Dies ist für genauere Werte nützlich, da so der Mittelwert von beiden Rechenergebnissen benutzt werden konnte. Hinsichtlich Herrn Klinks und meiner Messung für MAD 4 errechneten wir eine Alkalinität von 1343,4 bzw. 1441,6 Mikromol/Liter. Alle Werte wurden notiert und später in eine Tabelle mit weiteren Parametern übertragen, u.a. exakte Messungen aus dem Labor der Geochemie:
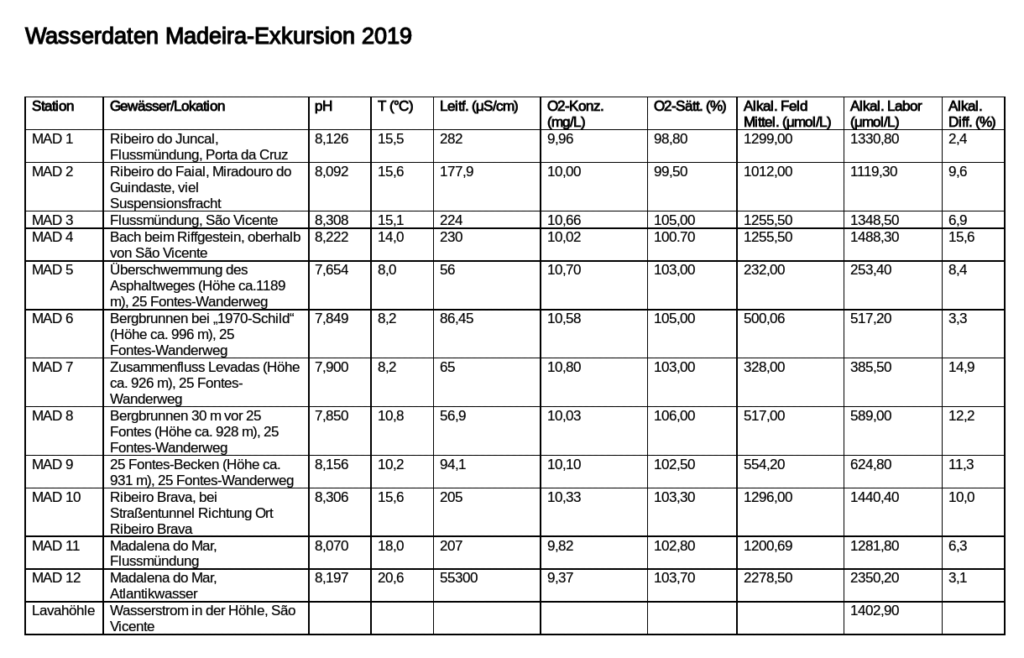
Dieser Tabelle ist u.a. zu entnehmen, dass wir den Umschlagpunkt in manchen Fällen relativ genau erkannt haben und eine Titration im Feld durchaus zuverlässige Ergebnisse hervorbringen kann. Der Zusammenhang zwischen besonders reinem Gebirgswasser und eine dementsprechend niedrige elektrische Leitfähigkeit ist auch gut erkennbar. Genauso weisen die hohen Werte der Leitfähigkeit bei Flussmündungen und beim Atlantikwasser auf viele Fremdstoffe und dementsprechend unreines Wasser hin. Diese Eigenschaft korreliert auch mit der Alkalinität, weil viele in der Lösung befindliche Ionen nicht nur die elektrische Leitfähigkeit erhöhen, sondern auch die Tendenz zum Verbinden zu einer Säure. Aus diesem Grund wurde vor Ort diese Graphik angefertigt:
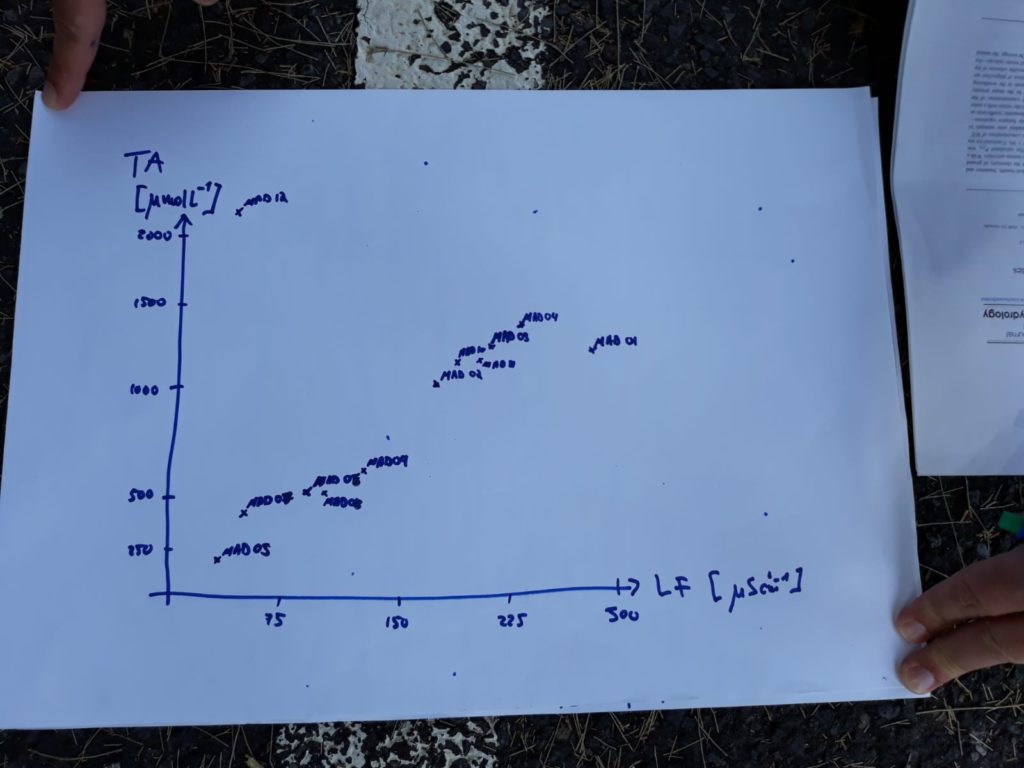
Bis auf den nachvollziehbaren extremen Ausreißer des Meerwassers (MAD 12) und einem weiteren Kleinerem (MAD 1), der durch eine Flussmündung erklärt wird, ist der lineare Zusammenhang der Messgrößen erfasst worden.
Abschließende Erläuterungen
In diesem Kontext betonten die Dozenten zusätzlich, dass eine in Papern belegte Proportionalität zwischen dem Kationen/Anionen-Verhältnis in den Wässern und der Alkalinität ein Zeichen für eine stabile Verwitterung auf Madeira ist. Weiterhin wurden die drei wesentlichsten Minerale genannt, die auf der Insel verwittern, nämlich zu 44 % Plagioklase, zu 30 % Olivine und zu 20 % Pyroxene. Ergänzend wurden die wesentlichsten Tonminerale genannt, die bei der Verwitterung eine Rolle spielen. Diese sind Sabronit, Montronit und Vermiculit. Anspielend auf das Fallbeispiel Machico https://madeira.blogs.uni-hamburg.de/tagebuch/12-maerz-2019-4-3/ wurde weiter erläutert, dass bei gut angelegten Dränagen Eisenoxide, Gibbsite und Allophane bei starken Niederschlägen eben nicht bewegt werden, wohingegen besonders Smektite für z.T. starke Rutschungen verantwortlich sind, sofern die Dränagen schlecht angelegt sind und immense Wassermassen diese überfordern.
Hinzu kam ein Blick auf den hydrologischen Kreislauf der Insel, indem man erst den durchschnittlichen Niederschlag in Funchal (600 mm/Jahr) mit Ponte Delgada (1000 mm/Jahr) an der Nordspitze der Insel und den ungefähren Werten für Niederschläge ab einer Höhe von 500 m (1000-3500 mm/Jahr) verglich. Eine darauf folgende Abschätzung, dass im Gebirge bei etwa 3300 mm/Jahr Niederschlag im Jahr 800-1000 mm im gleichen Zeitraum wieder abfließen, spräche laut den Dozenten für einen intensive hydrologischen Kreislauf, mit dem auch die sehr schnelle Verwitterung von weniger resistenten vulkanischen Gesteinen nachvollzogen werden kann.
Basierend auf der Titration wurde gesagt, dass etwa 1 mol Kohlenstoff pro Quadratmeter gebunden sind, was hochgerechnet bedeutet, dass ca. 12 Tonnen Kohlenstoff pro Quadratkilometer und Jahr auf Madeira gebunden werden. Dieser Wert entspricht dem Sechsfachen des Weltdurchschnitts an gebundenem Kohlenstoff und untermauert sehr anschaulich wieviel Kohlenstoffdioxid durch die überwiegend basaltischen Gesteine gebunden wird. Hierbei wurde auch auf Basaltmehl Bezug genommen und seine möglicherweise relevante Bedeutung für die Landwirtschaft, da das zu einem Gewichtsprozent enthaltene Mineral Apatit für die Düngung wichtigen Phosphor enthält.
Abschließend schweifte die ganze Gruppe in eine höchst interessante Diskussion zum Klimawandel ab, bevor der Exkursionsteil des Tages offiziell aufgelöst wurde und es jedem selbst überlassen wurde, das eigentlich noch zum Programm gehörende Westkap Madeiras anzuschauen.





